糖尿病已对全球超过4.63亿人的健康构成威胁,其中糖尿病溃疡是最严重的并发症之一,造成极高的患者截肢率和死亡风险。由于机体血糖调节机制失效,糖尿病患者创面常面临细菌感染、微环境氧化应激以及血管损伤等多重挑战,这些因素共同导致慢性伤口愈合延迟。在糖尿病伤口微环境中,活性氧(ROS)发挥着重要的作用:高水平ROS辅助抗菌治疗;在适当浓度下,ROS能够促进血管生成和细胞外基质重塑。然而,ROS的持续性过量产生会破坏细胞外基质合成,干扰细胞因子正常功能,从而形成影响糖尿病创面修复的恶性循环。基于糖尿病伤口微环境的复杂性,如何实现创面感染阶段ROS介导的抗菌作用以及修复阶段选择性清除过量ROS以缓解氧化应激的双向调节策略,在最大限度地提高糖尿病创面愈合速度和修复质量方面极具挑战性。
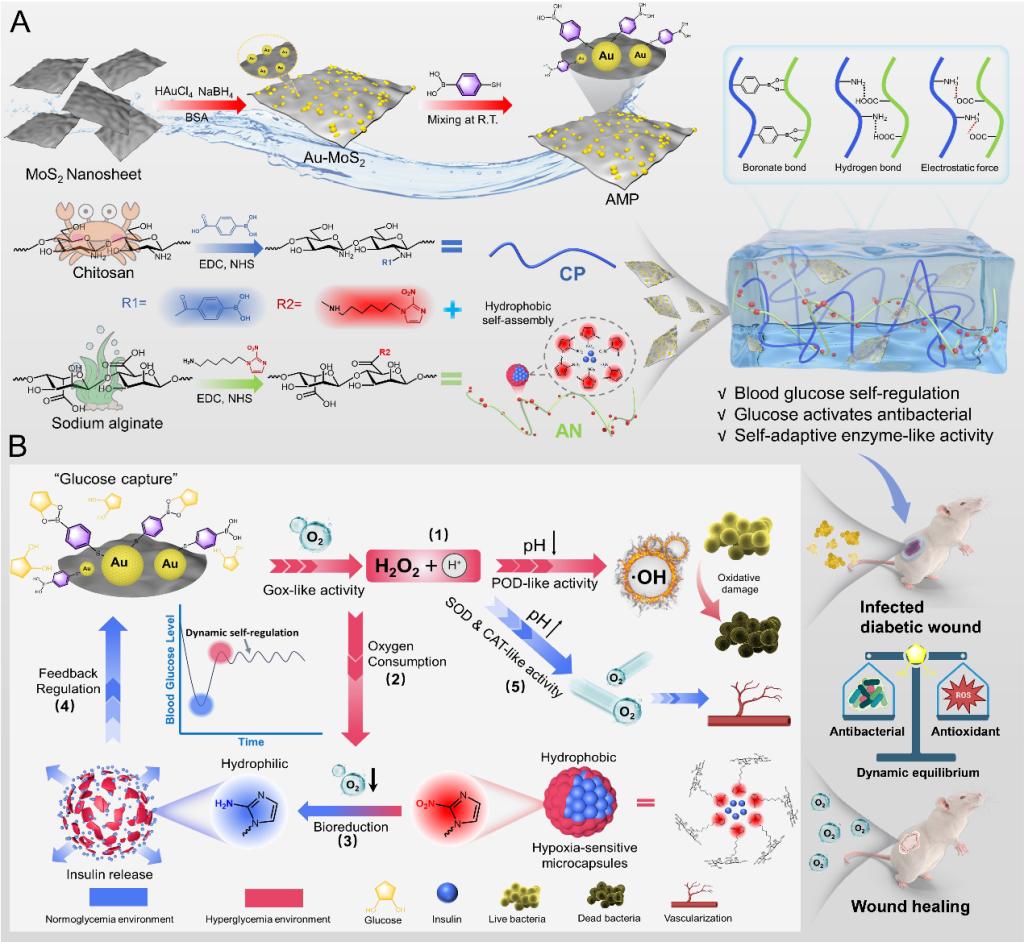
图1 葡萄糖激活程序化水凝胶用于感染糖尿病伤口愈合的示意图。
近期,郭保林教授团队设计了一种通过动态硼酸酯键、静电作用力和氢键交联的程序化自适应治疗水凝胶,水凝胶由苯硼酸改性壳聚糖(CP)、疏水性缺氧敏感2-硝基咪唑改性海藻酸钠(AN)和苯硼酸功能化Au-MoS2复合纳米酶(AMP)组成。AMP纳米酶能够适应创面微环境酸碱度自切换多种类酶活性。缺氧敏感2-硝基咪唑诱导两亲性AN在水相中自发卷曲形成微胶囊用于包裹胰岛素,并在缺氧条件下实现胰岛素按需输送。在高血糖环境中,水凝胶通过催化葡萄糖氧化产生ROS抗菌。在葡萄糖氧化后加剧的缺氧环境中,两亲性AN的硝基咪唑基团通过体内生物还原反应转化为亲水性氨基咪唑,破坏微胶囊的两亲性平衡实现按需释放胰岛素。在正常血糖环境中,水凝胶通过释放氧气抑制缺氧敏感微胶囊的结构转变,缓解组织缺氧。综上所述,这项研究通过开发一种新型葡萄糖激活自切换类酶活性水凝胶,根据血糖浓度变化适应性激活具有不同生物学功能的类酶活性,以动态反馈方式释放胰岛素调节机体血糖水平,实现了对糖尿病慢性伤口的适应性治疗,确保伤口愈合有序进行,这项工作为糖尿病伤口适应性治疗提供了新思路和方法。
该工作以“Glucose-Activated Programmed Hydrogel with Self-Switchable Enzyme-Like Activity for Infected Diabetic Wound Self-Adaptive Treatment”为题于2025年2月13日发表在《先进材料》(Advanced Materials)上(DOI:10.1002/adma.202419158)。
西安交通大学前沿科学技术研究院助理教授杨雨桐博士和硕士研究生方青青为论文的第一作者,西安交通大学前沿科学技术研究院郭保林教授为论文的通讯作者。该研究得到了国家重点研发计划、国家自然科学基金、世界一流大学(学科)和中央高校特色发展指导基金以及中央高校基本科研业务费专项的共同支持。

