慢性痛是一种严重的临床疾病,除单纯的疼痛感之外,还会引发焦虑、抑郁、恐惧等负性情绪,进而反向增加患者的疼痛感,形成疼痛-负性情绪-深度疼痛的恶性循环,极大损害患者身体健康、增加社会经济负担。据了解,全世界约20%的人口长期遭受该病痛的折磨。
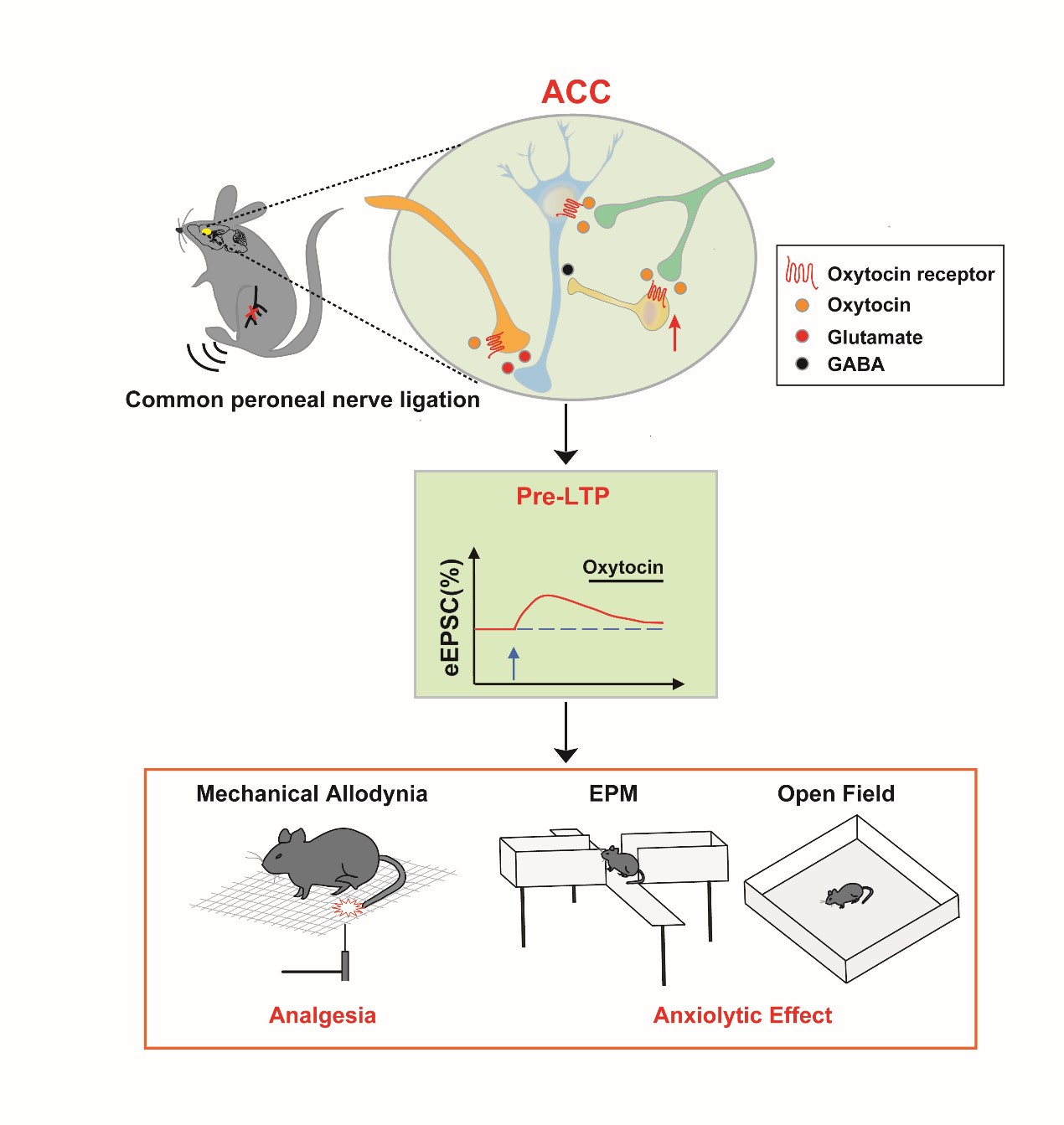
前沿院卓敏教授团队经过长期研究发现,慢性痛可以引起大脑皮层的突触可塑性变化,这些变化与慢性痛的痛觉和焦虑行为密切相关,而大脑皮层前扣带回区域(ACC)的突触传递的长时程增强(LTP)则是慢性痛重要的分子机制。2015年,卓敏院士团队在《Neuron》杂志刊文发现,成年小鼠的皮层突触存在一种依赖突触前红藻氨酸受体(KA受体)而不依赖NMDA受体突触前LTP(即Pre-LTP),于。在突触水平上,Pre-LTP增强神经递质的突触前释放,引起突触后受体的敏化,并通过这种增强的突触传递进一步导致焦虑和引起疼痛感觉加剧;抑制Pre-LTP的表达,则可以减弱慢性痛动物中的焦虑行为。
催产素(Oxytocin)是一种经典的神经垂体激素,由下丘脑中室旁核(PVN)和视上核(SON)的神经元合成释放到血液中,主要促进分娩和哺乳,以及产生抗焦虑和镇痛作用。诸多研究均表明,催产素可以减少人们的焦虑,增强社交能力,提高人们的幸福感觉,因此也被称为“爱的激素”。研究表明,低焦虑水平的人群的脑脊液和血浆中催产素浓度比较高。但催产素消除焦虑、缓解或治疗慢性痛的作用机制一直处于科研盲区。在中枢神经系统中,催产素还扮演神经递质的作用,但催产素是否调节中枢突触可塑性还不清楚。
卓敏教授团队最近利用转基因小鼠、光遗传学、电生理学以及药理学等综合技术研究发现催产素可以选择性地消除慢性痛导致的焦虑行为和焦虑相关的Pre-LTP,这种作用很可能是通过兴奋大脑皮层的抑制性神经元产生的。在腓总神经结扎(CPN)的慢性痛小鼠中,用高架十字迷宫(EPM)和旷场实验(Open field test)可以明显检测到小鼠的焦虑行为。当在ACC微量注射催产素的时候,可以显著减少慢性痛导致的焦虑行为。进一步使用光遗传的方法激活内源性催产素在ACC的释放也可以显著降低慢性痛相关的焦虑行为,而抑制内源性催产素的释放对焦虑行为没有明显影响。通过电生理研究发现,外源或内源性催产素选择性地抑制ACC神经元Pre-LTP的维持,而对Post-LTP没有影响。催产素兴奋抑制性中间神经元从而增强抑制性突触传递,该作用受到GABAA受体和G蛋白偶联受体调控的信号通路的调节。此外,在慢性痛动物中,还发现PVN的催产素浓度和ACC的催产素受体的表达都明显增加,表明慢性痛后催产素的功能被上调。
这篇研究工作发现了催产素抗焦虑的新机制,即催产素通过抑制皮层突触前LTP产生抗焦虑作用,并进一步证明了ACC的突触前LTP在慢性痛产生的焦虑中扮演重要的作用,也为未来药物研发或临床治疗焦虑提供了一个新的理论依据。
该研究结果以论文形式发表在Cell系列子刊《Cell Reports》上。论文题目为 “Oxytocin in the anterior cingulate cortex attenuates neuropathic pain and emotional anxiety by inhibiting presynaptic long-term potentiation”。前沿院博士后李旭辉和多伦多大学博士后Takanori Matsuura为本论文共同第一作者,前沿院为第一作者和通讯作者单位,卓敏教授为该论文的唯一通讯作者。这项工作也是卓敏教授课题组在慢性痛相关情绪研究领域又一重要突破。前沿院博士生薛曼、陈麒羽、刘任昊、史婉彤、樊珂欣、周兆祥及副研究员陆景珊博士参与了此项研究。李旭辉博士后获中国博士后基金和陕西省自然科学基础研究计划等项目的资助。
论文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(21)00824-X
卓敏教授课题组链接:http://fist.xjtu.edu.cn/cnd/index.htm
推荐阅读文献:
1. Li, X.H.,et al., Oxytocin in the anterior cingulate cortex attenuates neuropathic pain and emotional anxiety by inhibiting presynaptic long-term potentiation. Cell Reports 36, 109411, July 20, 2021.
2. Koga, K., et al., Coexistence of Two Forms of LTP in ACC Provides a Synaptic Mechanism for the Interactions between Anxiety and Chronic Pain. Neuron, 2015. 86(4): p. 1109.
3. Zhuo, M., Neural Mechanisms Underlying Anxiety-Chronic Pain Interactions. Trends Neurosci, 2016. 39(3): p. 136-145.
4. Robinson, D.A., et al., Oxytocin mediates stress-induced analgesia in adult mice. J Physiol, 2002. 540(Pt 2): p. 593-606.
5. Bliss, T.V., et al., Synaptic plasticity in the anterior cingulate cortex in acute and chronic pain. Nat Rev Neurosci, 2016. 17(8): p. 485-96.
6. Wang, H., et al., Identification of an adenylyl cyclase inhibitor for treating neuropathic and inflammatory pain. Sci Transl Med, 2011. 3(65): p. 65ra3.

